北京時間1月12日晚,杏鑫娱乐 -【杏鑫精彩无限】让生活更加多彩!(籌)藥杏鑫教授、中國科杏鑫深圳先進技術研究院醫藥所癌症免疫研究中心趙佳偉聯合哈佛大學醫杏鑫附屬波士頓兒童醫院教授Vijay Sankaran團隊通過群體遺傳學的方法⟹🙅🏽,發現了髓系惡性血液腫瘤易感性的重要家族風險因素,並揭示了轉錄延伸在其中的重要作用機制,相關成果發表在《細胞》雜志上。
血液腫瘤是一類常見的惡性腫瘤,與其他實體惡性腫瘤不同,髓系血液惡性腫瘤幾乎常見于各個年齡段🫎,具有明顯的可遺傳性。盡管近幾十年對血液惡性腫瘤發生的體細胞驅動突變(Somatic Driver Mutation)的發現和相關致病機理已經有了較完整的研究👱,我們對可遺傳的胚系突變(Germline Mutation)在血液腫瘤發生中的作用理解仍非常有限。
作為群體遺傳學的重要研究手段,全基因組相關聯研究(Genome Wide Association Study, GWAS)在識別和尋找可遺傳性胚系突變的致病作用中具有不可忽視的意義🌭。例如,胎兒向成人血紅蛋白素表達轉換的重要調控因子BCL11A的發現就要歸功于全基因組相關聯研究技術。然而🌬,全基因組相關聯研究技術在某些方面上卻具有天然的劣勢。這種劣勢主要表現在GWAS技術高度依賴于基因組測序技術以及大量樣本🧑🧒🧒,然而過去的幾十年內全基因組測序的高額費用使得GWAS技術僅僅只能應用于以微陣列技術為主體的發生頻率超過5%的常見突變體。從孟德爾經典遺傳學以及宏觀進化中可知,有害突變體的發生頻率通常非常低👨👩👦👦,而常見突變體的外顯率(Penetrance)通常比較低,因此通過GWAS的方法找到的常見突變體對惡性腫瘤形成的實際意義在遺傳學和癌症生物學中一直存在爭議。
然而,隨著全基因組測序技術日趨成熟☸️🚼,測序的費用也有了顯著的下降,越來越多的全基因組測序數據的釋放使得群體遺傳學進入了一個新紀元,即我們可以通過全基因組測序找到的罕見突變體來進行罕見突變體相關聯研究(Rare Variant Association Study, RVAS)🤾🏽♀️。通過RVAS找到的髓系惡性血液腫瘤易感性的重要家族風險因素(CTR9突變體)相比傳統GWAS找到的風險因素致病可能性具有顯著的提高(1000% v.s. 25%)。
CTR9是PAF1蛋白質複合體的重要支架蛋白,在結構上具有粘合PAF1蛋白質複合體其餘亞基CDC73🚵🏼🦸🏽♂️,PAF1,LEO1,WDR61的重要作用🈂️,而PAF1複合體通常被認為在RNA聚合酶進行轉錄延展時具有重大作用。在後續的研究中,趙佳偉發現當且僅當CTR9部分缺失時,人長期和短期造血幹細胞具有顯著性的擴增,且擴增的造血幹細胞是具備幹細胞功能的。從機制上,當CTR9部分缺失時🧑🏽,一部分PAF1複合體亞基將完全解離成為遊離的蛋白質,在這部分遊離的蛋白質中,CDC73和PAF1可以通過MLLT3加入另一個蛋白質複合體🌡,超級延展複合體(Super Elongation Complex, SEC)。加入了CDC73和PAF1的SEC可以特異性地提升與造血幹細胞自我更新相關的轉錄因子即其他相關蛋白質的mRNA延展效率👩🏿🎤,從而提高造血幹細胞的擴增。
該研究展現了群體遺傳學,特別是全基因組相關聯研究在複雜疾病致病機理中的巨大作用👨🏽,為家族性髓系惡性血液腫瘤發生的機理提供了新思路。同時🌥,此項研究揭示了以往尚未被解釋的PAF1複合體亞基與SEC的潛在關聯性🕵🏻♂️。鑒于SEC在多種血液腫瘤發生中具有不可或缺的作用,以PAF1複合體亞基與SEC結合的蛋白為靶點可能會成為某些類型的髓系白血病藥物發展的新思路。
趙佳偉教授、Liam Cato博士為本文共同第一作者,趙佳偉教授、Vijay Sankaran教授為本文共同通訊作者。
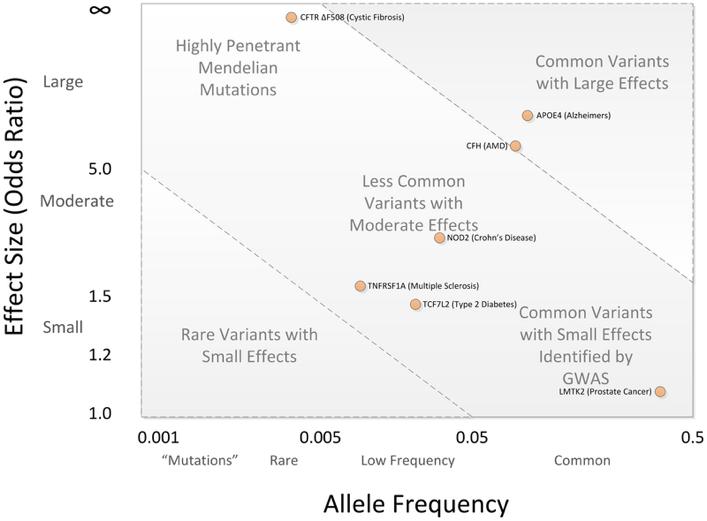
圖1 突變體/單堿基多樣性隨著發生頻率的下降造成更高的外顯率🤙✵。當等位基因頻率小于0.005且概率比例(odds ratio)大于5時,該突變體基本遵循孟德爾遺傳,而常見單堿基多樣性(發生頻率大于0.05)通常難以產生較大的概率比例,只有在捕捉到罕見單堿基多樣性時該等位基因才可能會對目標性狀具有較大影響。
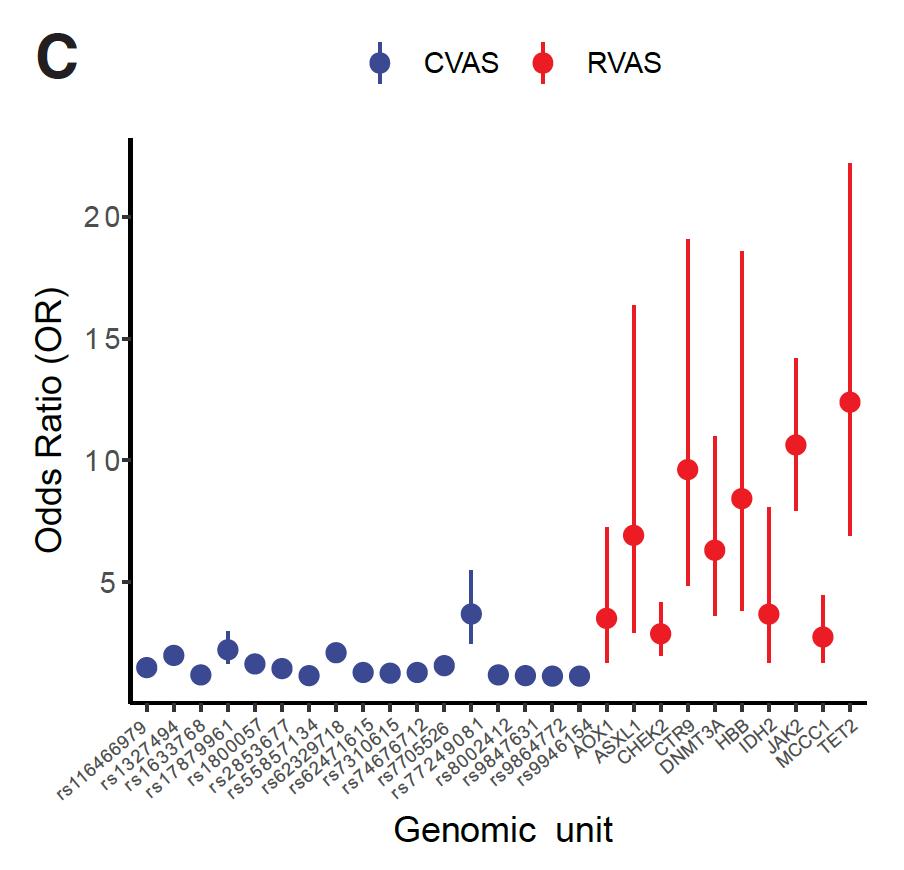
圖2 相對于常見單堿基多樣性的GWAS(CVAS),罕見單堿基多樣性(RVAS)的概率比例顯著提高,其造成的外顯率比例也顯著上升。
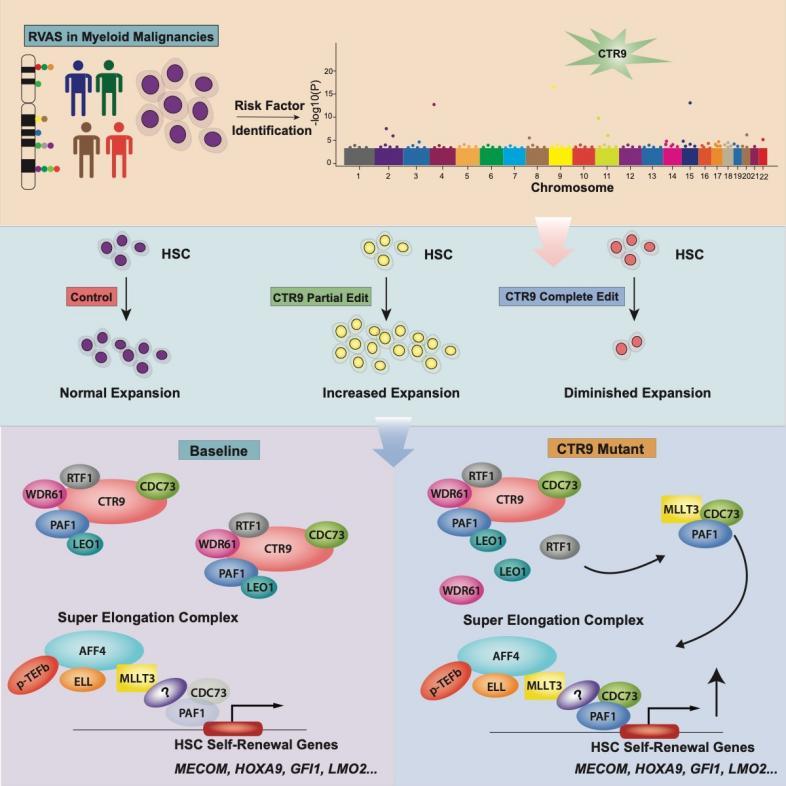
圖3 部分CTR9的缺失使得一部分PAF1複合體被拆解💂🏽♀️,釋放出的部分亞基,如PAF1和CDC73被超級延展複合體募集,從而增強與造血幹細胞穩態與自我更新有關的基因如MECOM, GFI1B, LMO2等的轉錄延展,從而調高這部分基因的表達,導致造血幹細胞擴增的後果。而CTR9/PAF1複合體作為一類管家基因對于細胞的存活是不可或缺的,因此CTR9完全缺失的造血幹細胞無法長期維持穩態🍽。
文章鏈接
